细胞焦亡(pyroptosis)是机体应对病原体感染的重要炎症性死亡方式,但其过度激活可能导致败血症等致命性炎症损伤。RING1作为多梳抑制复合物PRC1的核心组分,在表观遗传调控中发挥关键作用,但在炎症与感染中的功能尚不明确。2025年5月14日,复旦大学李继喜教授团队在《Cell Death & Differentiation 》杂志发表了题为“RING1 dictates GSDMD-mediated inflammatory response and host susceptibility to pathogen infection”的研究论文。该研究首次揭示RING1通过泛素化降解焦亡关键蛋白GSDMD,调控宿主对病原体感染的炎症反应。

本研究发现,RING1通过直接结合焦亡执行蛋白GSDMD,催化其第168和203位赖氨酸的K48连接型泛素化修饰,促进蛋白酶体依赖的降解,从而抑制细胞焦亡及IL-1β等炎症因子释放。动物实验表明,RING1基因缺失会显著加剧脂多糖(LPS)诱导的败血症死亡率,并导致沙门氏菌感染后脾脏细菌载量升高;在结核杆菌感染模型中,RING1缺失虽在早期促进病原体清除,但后期却加重肺部炎症扩散。研究进一步利用小分子抑制剂阻断RING1泛素连接酶活性,证实其通过降解GSDMD调控焦亡的分子机制,为靶向干预提供了实验依据。
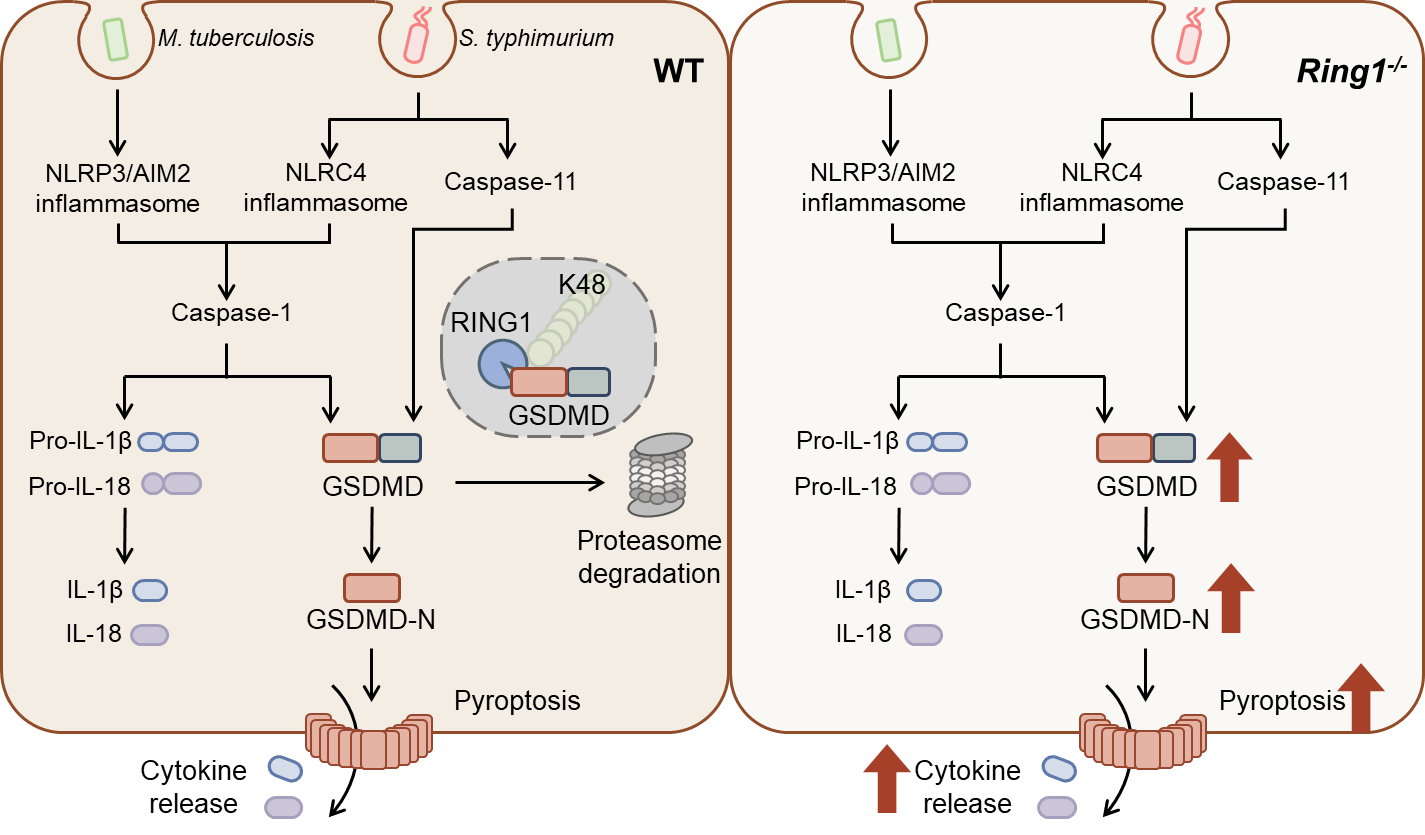
图1. RING1泛素化降解GSDMD并抑制细胞焦亡的分子机制
李继喜课题组长期致力于细胞死亡与免疫应答研究。在细胞焦亡领域,通过X-光晶体衍射的结构生物学方法解析了GSDMD-C的精细三维结构,阐明了GSDMD蛋白的自抑制结构基础(2017,Proc Natl Acad Sci USA)。系统揭示了泛素连接酶TRIM21(2021, Cell Death Differ)、TRIM25(2022, Cell Death Differ)以及转录因子SP1(2024, Cell Death Dis)等关键分子在程序性细胞死亡中的动态调控机制。
betway必威西汉姆联官方网站李媛媛博士、高文青博士和博士生邱雨欣为本文共同一作,李继喜教授为论文通讯作者。研究工作得到了国家自然科学基金委和上海市科委的支持。
论文链接:https://www.nature.com/articles/s41418-025-01527-2

